|
Forscher
>
Dr. Peter Golz
>
Quality by Design – Chancen für den Maschinenbau
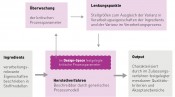
Quality by Design – Chancen für den MaschinenbauDefinierte QualitätWer bei „Quality by Design“ – QbD – an die sprichwörtliche Langlebigkeit und Zuverlässigkeit von Maschinenbauprodukten „made in Germany“ denkt, befindet sich vordergründig auf dem Holzweg. Denn im Pharmakontext bezieht sich QbD auf die Entwicklung und den Herstellprozess von Arzneimitteln. Ziel ist die wissensbasierte Herstellung von Arzneimitteln in definierter Qualität. Um die Vorteile des QbD-Ansatzes ausschöpfen zu können, bedarf es komplementär dazu Produktionsmaschinen, die mehr können, als zuverlässig das zugelassene Herstellverfahren zu reproduzieren. QbD – das Ziel Die Anforderungen an die Qualität des Herstellprozesses ergeben sich aus den Zulassungsunterlagen. Vorgegeben werden für jeden Produktionsschritt die Rezeptur der Inhaltsstoffe, das Herstellverfahren innerhalb empirisch ermittelter Verfahrensgrenzen sowie Akzeptanzkriterien für Qualitätsparameter. Im traditionellen Ansatz werden diese Qualitätsparameter überprüft und die jeweilige Produktionscharge nach analytischer Prüfung von Stichproben für den Markt freigegeben – oder verworfen. Hintergrund dieser Vorgehensweise ist, dass die Produktqualität auch in einem reproduzierbaren validierten Herstellverfahren und selbst bei mittels Inlineüberwachung verifizierter Einhaltung der vorgegebenen Verfahrensgrenzen auf allen Verarbeitungsstufen Schwankungen unterliegt, die zu einer Verletzung der festgelegten Akzeptanzkriterien führen können. Die Ursachen hierfür liegen in der Variabilität der Verarbeitungseigenschaften der Ausgangsstoffe sowie in nichtdeterministischen Eigenschaften der Herstellverfahren. Man lebt quasi mit diesen „Schwächen“ des Herstellprozesses. Qualität wird sichergestellt, indem Schlechtchargen aussortiert werden. Qualität wird ‚ertestet‘ – nicht produziert. Im Gegensatz dazu zielt QbD darauf, den Prozess so zu optimieren, dass bei ordnungsgemäßer Prozessführung innerhalb bekannter Prozessparametergrenzen alle Prozesschargen sicher innerhalb des durch Qualitätskriterien beschriebenen „Qualitätskorridors“ der Produktspezifikation liegen. Ansatzpunkte sind die genaue Kenntnis der Varianz in den qualitätsrelevanten Verarbeitungseigenschaften der Ausgangsstoffe und der Varianz im Herstellprozess einerseits sowie der Kompensation dieser Varianzen im Herstellprozess andererseits. Abbildung 1 zeigt schematisch die Regelkreisstruktur eines QbD-Herstellprozesses. Wenn dieser funktioniert, kann bei Verifizierung einer ordnungsgemäßen Prozessführung größtenteils auf die nachträgliche Qualitätskontrolle verzichtet werden. QbD – Respekt vor der Wissenslücke Das sieht schlüssig aus, und andere Industrien haben sich längst auf den Weg gemacht, ihre Qualitätsschwankungen in den Griff zu bekommen. Die Pharmaindustrie verharrt dagegen in den Startlöchern. Warum? Weil in der hochregulierten Pharmaindustrie ein hohes Maß an empirisch abgesichertem Prozesswissen erforderlich ist, um die Kriterien für eine ordnungsgemäße Prozessführung – d.h. den Design-Space – abzuleiten. Welche sind die qualitätsrelevanten Eigenschaften der Ausgangsstoffe? Wie verhalten sich diese im Herstellprozess? Welche Lenkungspunkte zum Ausgleich der Variabilität in den Ausgangsstoffen und des Herstellverfahrens sind verfügbar? Welche Daten müssen im Prozess gewonnen werden, um Soll-Ist-Abweichungen im Prozess erfassen zu können? Welche Schwellenwerte lösen korrektive Maßnahmen aus? Wann ist der Herstellprozess robust bzw. wann ist er als „nicht ordnungsgemäß“ einzustufen und die Produktionscharge zu verwerfen? Das zur Beantwortung dieser Fragen benötigte Wissen ist in der Regel nicht vorhanden und wird im traditionellen Zulassungsverfahren im Gegensatz zu Zulassungsverfahren mit QbD-Elementen von den Zulassungsbehörden bis dato nicht zwingend verlangt. QbD erfordert somit einen großen Sprung in Richtung wissensbasierter Produktion. Der Weg der kleinen Schritte in Form eines heuristischen iterativen Prozesses der kontinuierlichen Prozessverbesserung ist damit praktisch versperrt.
Abb. 1 Quality by Design – Schema Schema QbD: © VDMA FV NuV 2014
QbD – Gemeinsam die Grundlagen schaffen Pilotprojekte von Arzneimittelzulassungen mit QbD-Elementen zeitigten einen hohen Aufwand bei der Herleitung und Qualifizierung von Stoffmodellen und Prozessmodellen zur Ableitung des Design-Space. Dieser Aufwand könnte erheblich reduziert werden, wenn für die jeweiligen verfahrenstechnischen Prozessschritte bereits qualifizierte generische Stoffmodelle und Prozessmodelle bereitstünden, deren Anpassung auf den jeweiligen Anwendungsfall über empirisch zu bestimmende Parameter erfolgen könnte. Ausgehend von in der Zulassung festgelegten Qualitätskriterien könnte der Design-Space mit Hilfe von Simulationen spezifiziert und ggf. im Rahmen der Prozessvalidierung angepasst werden. Doch wer soll diese generischen Stoff- und Prozessmodelle entwickeln? Für einzelne Arzneimittel ist der Zusatzaufwand im Vergleich zur traditionellen Pharmaproduktion wirtschaftlich kaum zu rechtfertigen. Als Gemeinschaftsaufgabe der Pharmaindustrie und ihrer Zulieferindustrien könnte diese Herkulesaufgabe zu schaffen sein, z.B. im Rahmen eines Forschungsprogramms der vorwettbewerblichen Gemeinschaftsforschung. Den Anfang wagen! Quality by Design ist derzeit immer noch eine Vision für die Mehrheit der forschenden Arzneimittelhersteller. Doch warum sollte diese Vision im Bereich fester Arzneiformen nicht realisierbar sein? Bereits heute sind Apparate in den SUPAC-Guidelines in Form von Unterklassen (Subclasses) generisch beschrieben. Warum sollten sich diese als „ähnlich“ angesehenen Maschinen und Apparate nicht als parametrisierbares Prozessmodell beschreiben lassen? Für den Maschinen- und Apparatebau würde sich die Möglichkeit eröffnen, ihre Produkte auf der Grundlage der Prozessmodelle zu entwickeln. Verfahrensoptimierungen werden dadurch wesentlich erleichtert, soweit sie auf dem gleichen qualifizierten generischen Prozessmodell beruhen und die Randbedingungen des Design-Space eingehalten werden. Die Kombination mehrerer nacheinander folgender Prozessschritte zu einem quasikontinuierlichen Verfahren könnte aus Sicht der Zulassungsbehörden als Parameteränderungen innerhalb des validierten Design-Space angesehen werden. Das gleiche gilt für das Scale-up und für die Verlagerung von Produkten auf Maschinen, die auf dem jeweils gleichen Prozessmodell beruhen. Die Einsparungen durch erleichterte Meldeverfahren oder sogar deren Entfall auf Industrieseite einerseits sowie durch einen verringerten Prüfungsaufwand seitens der Zulassungsbehörden andererseits wären bedeutend. Eine neue Maschinengeneration „ready for QbD“ böte damit dem Anwender neben verbesserter Prozessbeherrschung eine Reihe weiterer Vorteile. Wir werden die Vision nicht in einem Sprung realisieren können. Was hindert uns aber daran, den ersten Schritt zu tun und an einfachen Verfahrensschritten Erfahrungen zu sammeln?
Beide Autoren sind überzeugt, dass QbD ein wichtiger Baustein zur Stärkung der Pharmaproduktion und des Pharmamaschinenbaus in den D-A-CH-Ländern Foto: © istockphoto.com| lchumpitaz; panthermedia| sellingpix |
C&M 4 / 2014
Das komplette Heft zum kostenlosen Download finden Sie hier: zum Download Die Autoren:Weitere Artikel online lesenNewsAhlborn GmbH: Hochgenaue Temperaturmessung mit digitalen FühlernBei über 80 % aller industriellen Messaufgaben werden Temperaturen gemessen. Wichtig ist das Zusammenspiel von Messgerät und Fühler sowie die verwendete Technologie. Aus der Präzisionsschmiede, der Firma Ahlborn aus Holzkirchen bei München, kommt jetzt ein Messsystem für hochgenaue Temperaturmessung, das nicht nur im Labor verwendet werden kann.© Ahlborn Mess- und Regelungstechnik GmbH |
Suche: