|
Verbessertes Prozessverständnis
Verbessertes ProzessverständnisDie UCD Pharmaceutical Process Engineering Research Group am University College Dublin (UCD) hat sich einen internationalen Ruf im Bereich Design, Optimierung und Scale-Up pharmazeutischer und biopharmazeutischer Prozesse erarbeitet und kooperiert mit zahlreichen großen internationalen Unternehmen. chemie&more sprach mit dem Gründer und stellvertretenden Direktor des Solid State Pharmaceutical Cluster (SSPC), Prof. Brian Glennon. chemie&more: Könnten Sie uns ein wenig über das SSPC und seine Aufgaben berichten? Brian Glennon: Das Solid State Pharmaceuticals Cluster (SSPC), welches von der Science Foundation Ireland (SFI) gegründet wurde, soll das erforderliche Fachwissen für die umfassende Untersuchung pharmazeutischer Prozesse bündeln, indem sich ergänzende akademische und industrielle Gruppierungen aus den Bereichen Chemie, Pharmazie, Arzneimittelherstellung, Chemieingenieurwesen und Maschinenbau zusammengebracht werden. Diese Gruppen verfügen über Fachwissen zu Prozessmodellierung und -auslegung, Scale-Up, numerischer Strömungssimulation, In-situ-Lösungs- und Festphasenüberwachung, Kristallografie und Pulvercharakterisierung.
Schwer detektierbare durch PVM® nachweisbare polymorphe Kristallform
Nadelförmige Kristalle führen oft zu langen und problematischen Filtrationen
Agglomeratbildung und Abrasion, sichtbar durch PVM®
Das SSPC bietet ein technisches Forum für Ingenieure und Wissenschaftler aus Unternehmen und Hochschulen, in dem pharmazeutische Prozessgestaltung und Initiativen zu bewährten Vorgehensweisen besprochen werden können. Da Irland der weltweit größte Arzneimittelexporteur ist, hat das SSPC durch Förderung und Erweiterung seiner Präsenz in Irland an strategischer Bedeutung gewonnen. Könnten Sie uns einen Überblick über die dadurch geleistete Arbeit geben? Das Cluster beschäftigt sich hauptsächlich mit drei Forschungsbereichen. // Bereich 1: Prozesskristallisation Der Schwerpunkt dieses Bereichs liegt auf Gestaltung, Optimierung und Scale-Up von Kristallisationsprozessen. Zu diesem Bereich gehört das Continuous Crystallization Platform Project (CCPP), eine Kooperation zweier akademischer Institute (UCD und UL) und fünf großer Pharmazieunternehmen (Pfizer, GSK, Roche, Eli Lilly und Merck). Ziel dieser Kooperation ist es, eine durchgehende Plattform für die Bewertung und Gestaltung kontinuierlicher Kristallisationsprozesse zu entwickeln. // Bereich 2: Partikeltechnik Dieser Bereich arbeitet an der Entwicklung von Technologien zur Bereitstellung bestimmter Partikeleigenschaften in Bezug auf Größe, Verhalten, Dichte usw. // Bereich 3: Wirkstoff (API)-Arzneimittel-Schnittstelle Dieser Bereich dient der Entwicklung einer Struktur von bewährten Vorgehensweisen zur Reduzierung der wissenschaftlichen Lücke zwischen der Wirkstoffherstellung und der Formulierung von Arzneimitteln.Dazu beschäftigt das SSPC sechs Projektleiter, zehn Post-Doktoranden und ca. 50 Doktoranden. Im Gegenzug bietet es eine große Forschungsinfrastruktur, welche die internen Forschungsstrategien unserer Mitglieder aus der Industrie hervorragend ergänzt. Wo liegen bei Ihrer Arbeit mit Partnern aus der Industrie normalerweise die Herausforderungen im Bezug auf Kristallisation und Scale-Up? Im Allgemeinen werden ein Scale-Up und die damit verbundenen Herausforderungen aus zwei Blickwinkeln betrachtet – aus wirtschaftlicher und wissenschaftlicher Sicht. Aus wirtschaftlicher Sicht geht es im Grunde darum, die wirtschaftliche Seite des Prozesses mit den Aspekten der Herstellung zu verschmelzen. In der Vergangenheit haben wir Chemieingenieure uns häufig darauf konzentriert, Zielerträge innerhalb kurzer Zykluszeiten zu liefern. Heute versuchen wir immer noch, ein Produkt mit angemessenem Ertrag, der geforderten Reinheit und der richtigen Partikelgröße zu erzeugen. Allerdings sind die Pulvereigenschaften wie Schüttdichte, Fließfähigkeit und Komprimierbarkeit des Pulvers, Bioverfügbarkeit usw. aufgrund ihres Einflusses auf die Formulierung von Arzneimitteln ebenso wichtig, wenn nicht sogar wichtiger. Bei Zwischenstufen geht es hauptsächlich um Durchsatz und Ertrag und diese Schritte bieten sowohl im Hinblick auf verkürzte Zykluszeiten als auch auf eine verbesserte nachgeschaltete Verarbeitung großartige Optimierungsmöglichkeiten. Mit dem finalen API-Schritt sind jedoch viel mehr Herausforderungen verbunden und die Optimierung der Zykluszeiten ist hier weniger wichtig als die Herstellung eines Produktes mit den gewünschten Ertrags- und Pulvereigenschaften. Wenn wir ein Scale-Up aus wissenschaftlicher Sicht betrachten, liegen die typischen Herausforderungen in der übermäßigen Bildung von Feinanteilen, einer schlechten Partikelmorphologie oder allgemein in der Herstellung von Partikeln mit unerwünschten Merkmalen oder Eigenschaften. Im Grunde geht es hauptsächlich um die Partikeleigenschaften! Können Sie kurz eine Strategie mit bewährten Vorgehensweisen für die Entwicklung eines stabilen und skalierbaren Prozesses beschreiben? Der Ausgangspunkt bei der Entwicklung eines beliebigen Kristallisationsprozesses ist die Identifizierung des so genannten „Design Space“ für die Löslichkeit. Dadurch wird der optimale Ablauf (Kühlen, Zugabe von Antisolvents usw.) für einen maximalen Ertrag des Produkts bestimmt. Der nächste Schritt besteht darin festzustellen, ob für den Prozess ein Animpfen erforderlich ist oder nicht (Keimbildung). Es ist sehr wichtig, die Anforderungen an die Impfkristalle im Hinblick auf die Kontrolle der Partikelgröße und die polymorphe Form zu kennen. Manchmal sind Impfkristalle unbedingt erforderlich, manchmal nicht. Dann führen wir einige Experimente aus, um die Keimbildung und die Wachstumsrate bei verschiedenen Übersättigungsstufen einschätzen zu können. Dies dient dazu, die Kristallisation bezüglich ihrer Kinetik „einzuordnen“. Abhängig von der Kinetik können verschiedene Strategien eingesetzt werden. Wenn beispielsweise ein Prozess mit einer langsamen Keimbildungskinetik vorliegt, ist es sehr wahrscheinlich, dass aufgrund der großen Breite des metastabilen Bereichs (MSZW, Metastable Zone Width) und der späteren Schwierigkeit, eine gleichmäßige Keimbildung und durchgängiges Wachstum sicherzustellen, ein Animpfen erforderlich ist. Andererseits kann für ein Molekül mit schneller Kinetik häufig ein stabiler Prozess auch ohne den Einsatz von Impfkristallen entwickelt werden, da der Zeitpunkt der Keimbildung relativ stabil und gleichbleibend ist. Man muss hierbei jedoch beim Scale-Up vorsichtig sein und sicherstellen, dass diese Konsistenz beim Keimbildungspunkt erhalten bleibt.
Versuchsanordung für Experimente mit höchstem Informationsgehalt. EasyMax™ mit PVM®, FBRM® und ReactIR™ Sondentechnologie
Ist die Kinetik des Prozesses einmal ermittelt, besteht der nächste Schritt in der Überwachung und Steuerung der Übersättigung. Hierbei versuchen wir, den Einfluss von Chargenübersättigungsprofilen auf die Leistung der Kristallisation im Hinblick auf Keimbildung und Wachstum sowie Partikeleigenschaften, Ertrag und Reinheit zu ermitteln. Zuletzt setzen wir eine automatische Regelung für die Übersättigung um, um die Entwicklungsstrategie in Bezug auf Kühlung oder Zugabe von Antisolvens automatisieren zu können. Zweck der Regelungsstrategie ist es, wichtige Qualitätsattribute wie Reinheit, Formfaktor, Partikelgröße usw. Welche Analysetechniken setzen Sie für Ihre Scale-Up-Strategie hauptsächlich ein? Als standardmäßige bewährte Vorgehensweise zielen wir auf Experimente mit hohem Informationsgehalt ab. Dies erreichen wir durch eine In-situ- und Echtzeitüberwachung der Prozessdynamikt. Unser Ziel ist es, die Kristallisation als Prozess und nicht als Endergebnis zu betrachten. Bei vielen älteren Prozessen wird die Offline-Partikelgrößenverteilung am Ende der Kristallisation betrachtet und aus diesem einen Datenpunkt wird dann versucht abzuleiten, was während des gesamten Kristallisationsprozesses geschehen ist. Das ist praktisch unmöglich und nur begrenzt hilfreich. Wir plädieren hingegen für In-situ-Experimente mit großem Informationsgehalt, mit denen man die Dynamik der Kristallisation als Prozess nachvollziehen kann. So sind wir in der Lage, die grundlegenden Partikelmechanismen zu erkennen, die einem bestimmten Kristallisationsprozess zu Grunde liegen. Die grundlegenden Partikelmechanismen, die ich meine, sind Keimbildung, Partikelwachstum, Agglomeration, Abrieb und Bruchverhalten. Die In-situ-Methoden, mit denen wir häufig arbeiten, sind FBRM® und PVM® (Mettler-Toledo GmbH) zur Partikelcharakterisierung und -messung, ReactIR™ (Mettler-Toledo GmbH) zur Messung und Regelung des Übersättigungsprofils und Raman (Kaiser Optical Systems) für die Überwachung der polymorphen Form. Zu den Techniken, die wir weniger häufig einsetzen, gehören Trübung, HPLC, Offline-Laserbeugung und Offline-Mikroskopie.
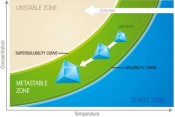
Design Space mit möglicher Route einer Kristallisation
Integrieren Sie die Prozessmodellierung in Ihre Scale-Up-Strategie? Für „Batch“-Prozesse verwenden wir Prozesssimulationssoftware, z.B. DynoChem®, für Löslichkeitsprüfungen, Wärmeübertragungs- und Mischungsberechnungen sowie zur Ermittlung der Unterschiede in Bezug auf diese Eigenschaften. Im Grunde versuchen wir, den Prozess im Labor und dann wiederum in der Anlage aufzuzeichnen und dabei den nötigen Experimentieraufwand zu minimieren. Für schnelle Fällungsprozesse verwenden wir häufig die numerische Strömungssimulation, um die Mischumgebung im Labor und im realen Prozess besser nachvollziehen zu können. Für kontinuierliche Prozesstechnik wird jedoch eine fortschrittlichere Modellierung der Kinetik und der Populationsbilanz eingesetzt, um die Kristallgröße und den „Design Space“ des Ertrags zu ermitteln. Auf diese Weise wird die Anzahl der erforderlichen Laborexperimente minimiert. Bei kontinuierlichen Prozessen dauert es wesentlich länger, sinnvolle experimentelle Daten zu erhalten, sodass die Modellierung unbedingt erforderlich ist. Wir haben festgestellt, dass es im „Batch“-Betrieb viel zu lange dauert, ein Modell zu erstellen im Vergleich zur Anzahl wertvoller Experimente, die in der gleichen Zeit ausgeführt werden können. Unter Zeitdruck ist es viel sinnvoller, gute, umsetzbare Informationen zu erarbeiten, als ein Modell zu erstellen, daher bevorzugen wir informationsreiche Experimente mit In-situ-Analytik. Durch diese Herangehensweise erfahren wir mit einer minimalen Anzahl von Experimenten extrem viel über unsere Prozesse. Was war Ihre größte Herausforderung im Hinblick auf die Prozessentwicklung? Diese Frage ist ziemlich schwer zu beantworten, da alle Prozesse ihre eigenen einzigartigen Herausforderungen und Probleme bergen. Besonders schwierig war jedoch die Vermeidung eines Rekristallisationsschritts mit anschließendem Mahlvorgang. Wir mussten im Grunde aus einem dreistufigen Prozess einen einstufigen machen. Ziel war es, Partikel mit einem d90 von 4 Mikrometern herzustellen. Zuvor wurde dazu ein dreistufiger Prozess mit einer Rohkristallisation, einer Rekristallisation und schließlich einem Mahlschritt benötigt, um die erforderliche Partikelgröße zu erzielen. Dieser Prozess nahm Tage in Anspruch und beim Mahlen kam es zu hohen Ertragsverlusten, da mehrere Durchgänge nötig waren, um die richtige Partikelgröße zu erreichen. Die Reinheit war ebenfalls ein Problem, da die hohe Energieeinwirkung auf die Kristalle während des Mahlens zu polymorphen Transformationen führte. Wir waren in der Lage, einen einstufigen Prozess zu entwickeln und durchgängig einen d90 von 4 Mikrometern zu erzielen. Durch eine Kombination von Inline-Analysentechnologien, speziell FBRM® und ReactIR™, konnten wir Prozesskinetik und -verhalten deutlich besser verstehen, was für die Umgestaltung des Prozesses ausschlaggebend war. Wie sieht die Zukunft der Kristallisation in der Branche aus? Zurzeit besteht ein großes Interesse an kontinuierlichen Prozessen. Im Hinblick auf die Synthese wird im Bereich der kontinuierlichen Reaktionsprozesse viel Interessantes erforscht. Da jedoch der Großteil der Arzneimittel weiterhin in Pulverform hergestellt werden wird, müssen der Reaktions- und der Kristallisationsschritt zusammengeführt werden. Reaktion und Kristallisation müssen also quasi in einem einzigen Verarbeitungsschritt erfolgen. Eine weitere zukünftige Entwicklung wäre ein verstärkter Einsatz von automatischer Regelung und Modellvorhersagen in industriellen Umgebungen. Durch solche Verfahren kann die Qualität der Prozesse deutlich gesteigert werden. Dies führt zu weniger Prozessabweichungen und damit zu einem einheitlicheren Produkt mit den gewünschten Pulvereigenschaften und der richtigen Partikelgröße. Der erste Schritt hin zu solch fortschrittlichen Regelungsstrategien wäre ein verbessertes Prozessverständnis. Fortschrittliche Inline-Prozessanalysetechniken wie die bereits erwähnten FBRM®, PVM®, ReactIR™ und Raman sind dafür unerlässlich. Mit diesem Verständnis können Prozesse gut optimiert werden. Das bedeutet, dass deutliche finanzielle Einsparungen erzielt werden können, ohne dass komplexere Regelungsstrategien nötig wären. Titelfoto: rotholl.at, Abbildungen: Mettler-Toledo |
C&M 3 / 2012
Das komplette Heft zum kostenlosen Download finden Sie hier: zum Download Der Autor:Weitere Artikel online lesenNewsAhlborn GmbH: Hochgenaue Temperaturmessung mit digitalen FühlernBei über 80 % aller industriellen Messaufgaben werden Temperaturen gemessen. Wichtig ist das Zusammenspiel von Messgerät und Fühler sowie die verwendete Technologie. Aus der Präzisionsschmiede, der Firma Ahlborn aus Holzkirchen bei München, kommt jetzt ein Messsystem für hochgenaue Temperaturmessung, das nicht nur im Labor verwendet werden kann.© Ahlborn Mess- und Regelungstechnik GmbH |
Suche: